政策法規(guī) || 罕見疾病藥物開發(fā)中疾病自然史研究指導原則(附法規(guī)概覽07.24-07.28)
01
國家藥監(jiān)局藥審中心關于發(fā)布《罕見疾病藥物開發(fā)中疾病自然史研究指導原則》的通告(2023年第43號)

掃描識別圖中二維碼
查看詳細信息

02
國家藥監(jiān)局藥審中心關于發(fā)布 《以患者為中心的藥物臨床試驗設計技術指導原則(試行)》《以患者為中心的藥物臨床試驗實施技術指導原則(試行)》《以患者為中心的藥物獲益-風險評估技術指導原則(試行)》的通告(2023年第44號)
掃描識別圖中二維碼
查看詳細信息

本周法規(guī)
CDE
01
關于《乙酰半胱氨酸顆粒生物等效性研究指導原則(征求意見稿)》等五項技術指導原則公開征求意見的通知

掃描識別圖中二維碼
查看詳細信息

02
國家藥監(jiān)局藥審中心關于發(fā)布《中藥新藥臨床試驗用藥品的制備研究技術指導原則(試行)》的通告(2023年第41號)

掃描識別圖中二維碼
查看詳細信息

03
關于公開征求《細胞和基因治療產品臨床相關溝通交流技術指導原則(征求意見稿)》意見的通知
掃描識別圖中二維碼
查看詳細信息

04
國家藥監(jiān)局藥審中心關于發(fā)布《其他來源于古代經典名方的中藥復方制劑藥學研究技術指導原則(試行)》的通告(2023年第42號)

掃描識別圖中二維碼
查看詳細信息

05
關于《腺相關病毒載體類體內基因治療產品臨床試驗申請藥學研究與評價技術指導原則(征求意見稿)》征求意見的通知
掃描識別圖中二維碼
查看詳細信息

06
關于公開征求《放射性標記人體物質平衡研究技術指導原則(征求意見稿)》意見的通知
掃描識別圖中二維碼
查看詳細信息

NMPA
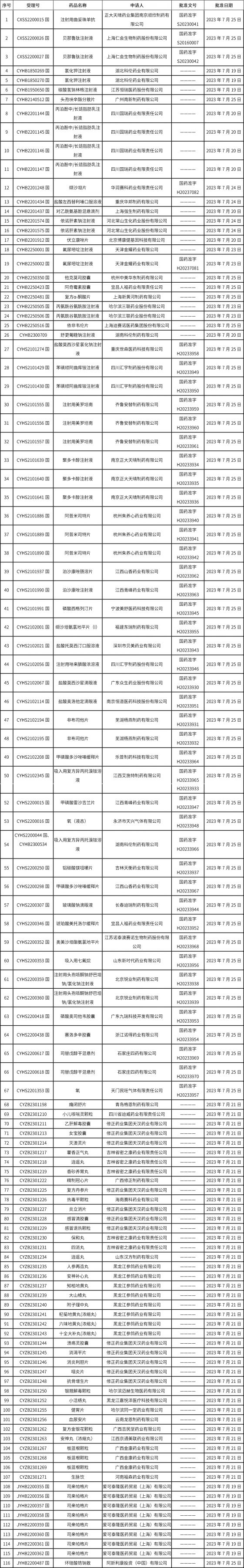
1、截止2023年7月28日 17:00本周發(fā)布117個待領取藥品批準證明文件,其中注射液25個,11個一致性評價品種。
02
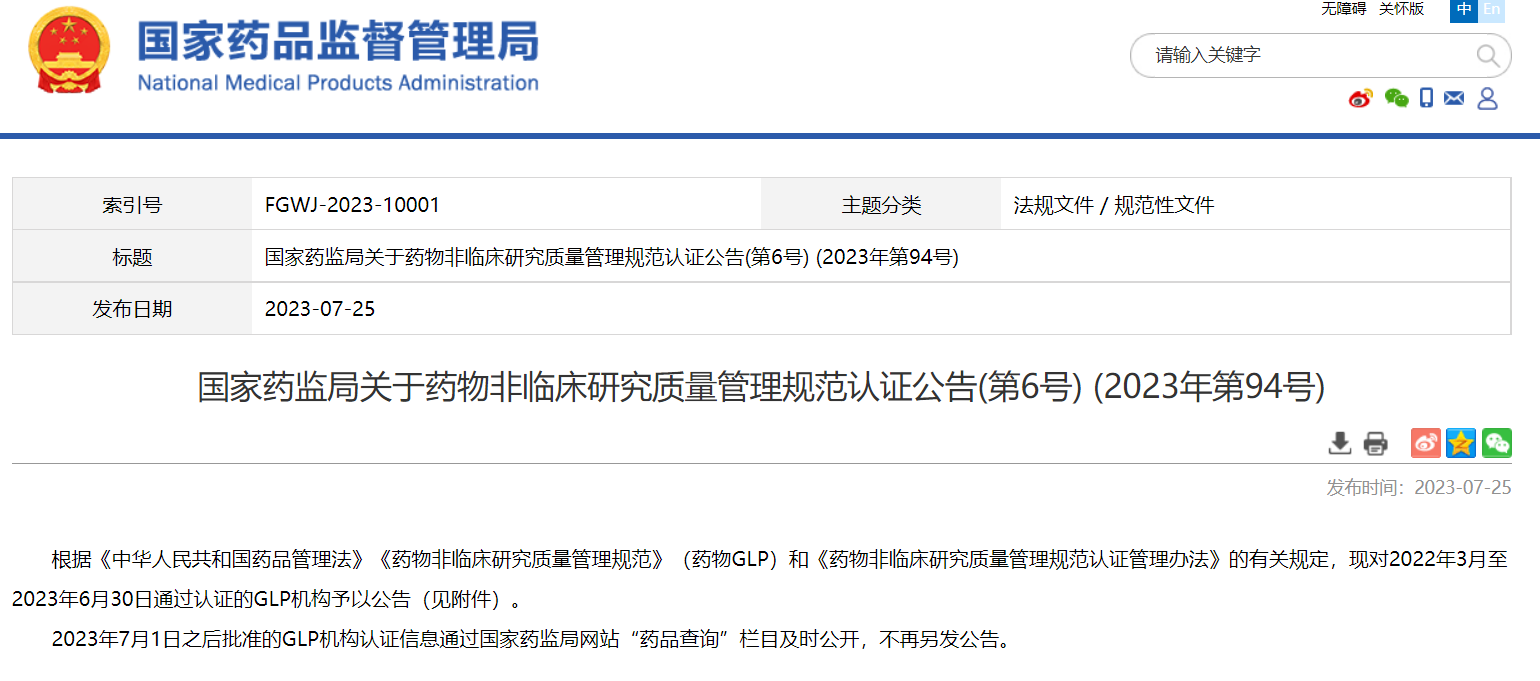
國家藥監(jiān)局關于藥物非臨床研究質量管理規(guī)范認證公告(第6號) (2023年第94號)
掃描識別圖中二維碼
查看詳細信息

03
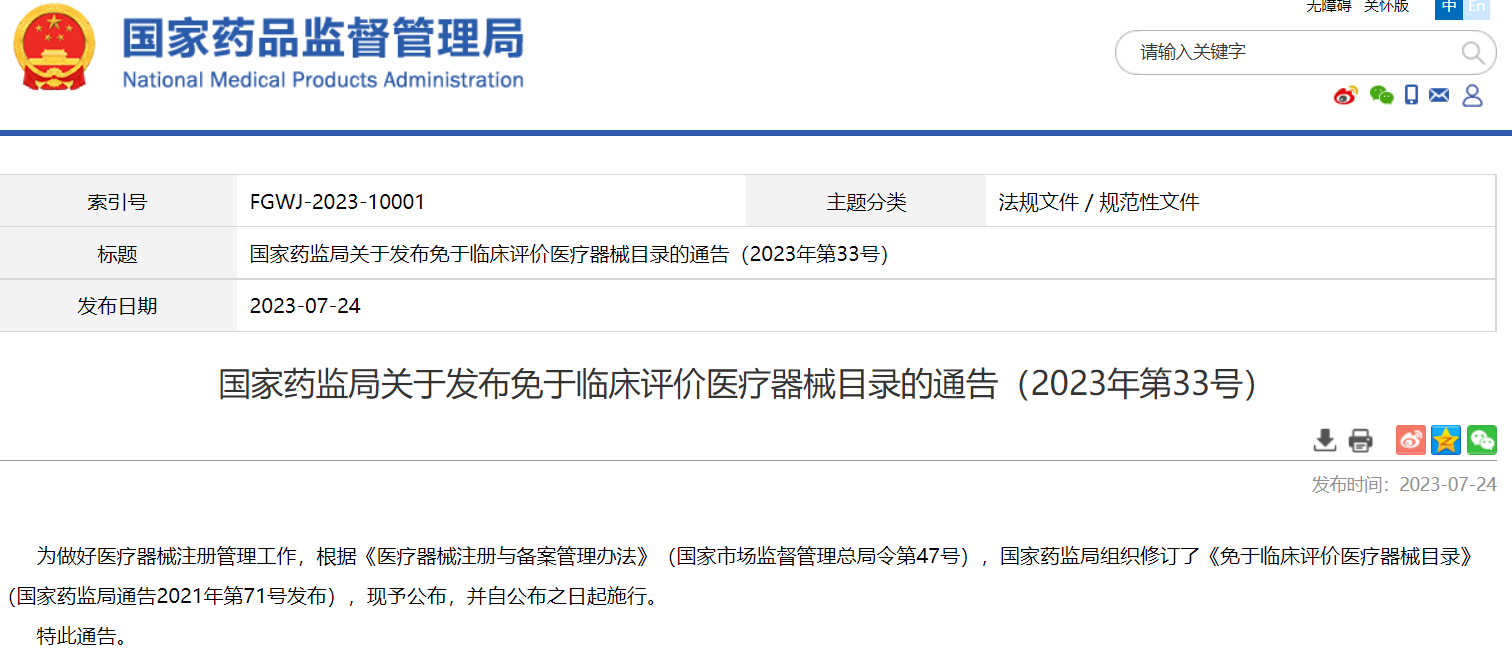
國家藥監(jiān)局關于發(fā)布免于臨床評價醫(yī)療器械目錄的通告(2023年第33號)
掃描識別圖中二維碼
查看詳細信息

04
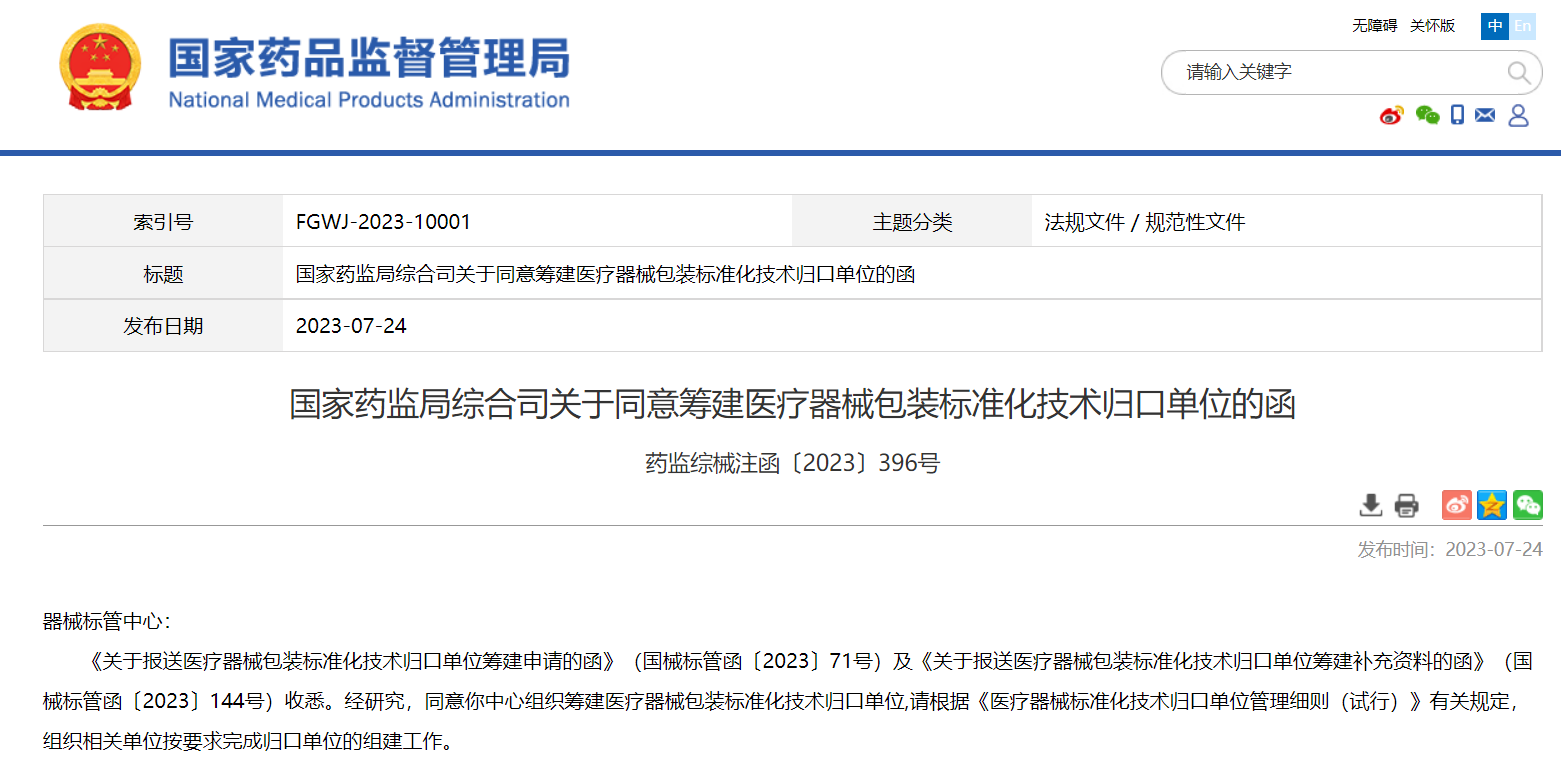
國家藥監(jiān)局綜合司關于同意籌建醫(yī)療器械包裝標準化技術歸口單位的函
掃描識別圖中二維碼
查看詳細信息

-END-


轉載聲明:未經本網或本網權利人授權,不得轉載、摘編或利用其他方式使用上述作品。已經本網或本網權利人授權使用作品的,應在授權范圍內使用,并注明“來源:新領先醫(yī)藥科技”。

 Hotline服務熱線:010-83057670
Hotline服務熱線:010-83057670
 簡體中文
簡體中文

 010-83057670
010-83057670 聯(lián)系地址:
聯(lián)系地址: 技術市場部:
技術市場部: 北京新領先
北京新領先 新領先藥訊
新領先藥訊 010-61006450
010-61006450
