政策法規 || 罕見病基因治療產品臨床試驗技術指導原則征求意見稿(附法規概覽09.11-09.15)
發布時間:2023-09-15
關于公開征求《罕見病基因治療產品臨床試驗技術指導原則(征求意見稿)》意見的通知

掃描圖中二維碼
查看詳細信息

CDE
01
關于公開征求《間充質干細胞防治移植物抗宿主病臨床試驗技術指導原則(征求意見稿)》意見的通知

掃描查看詳細信息

02
關于舉辦“創新藥臨床研究與評價技術指導原則主題線上宣講會”的通知
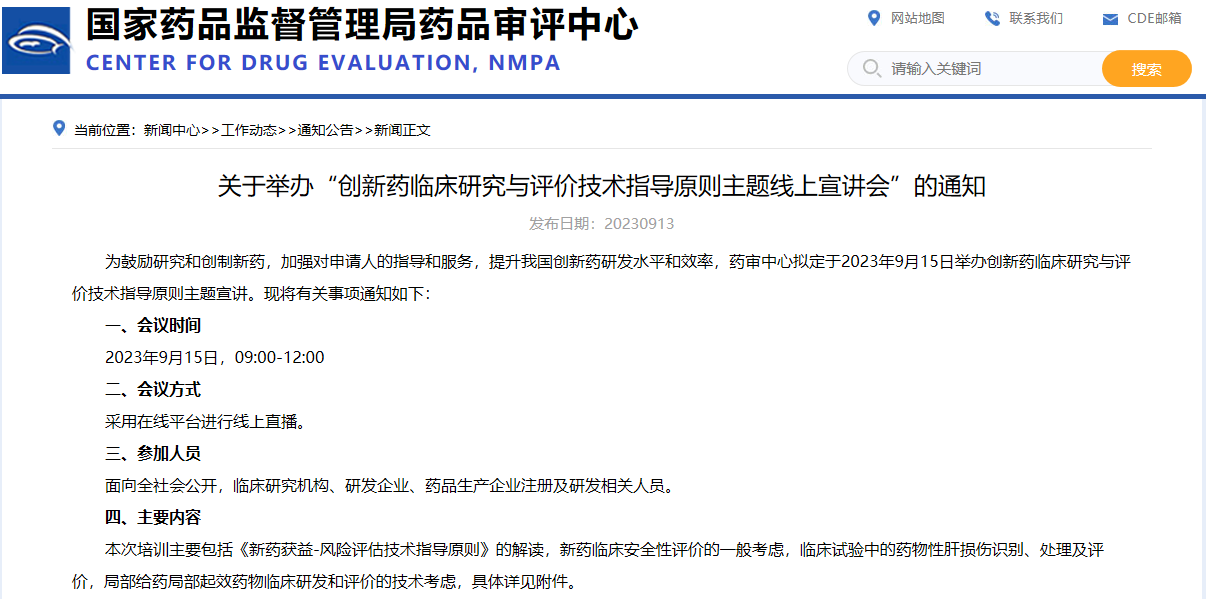
掃描識別圖中二維碼
查看詳細信息

NMPA
01
國家藥監局 公安部 國家衛生健康委關于調整麻醉藥品和精神藥品目錄的公告(2023年第120號)
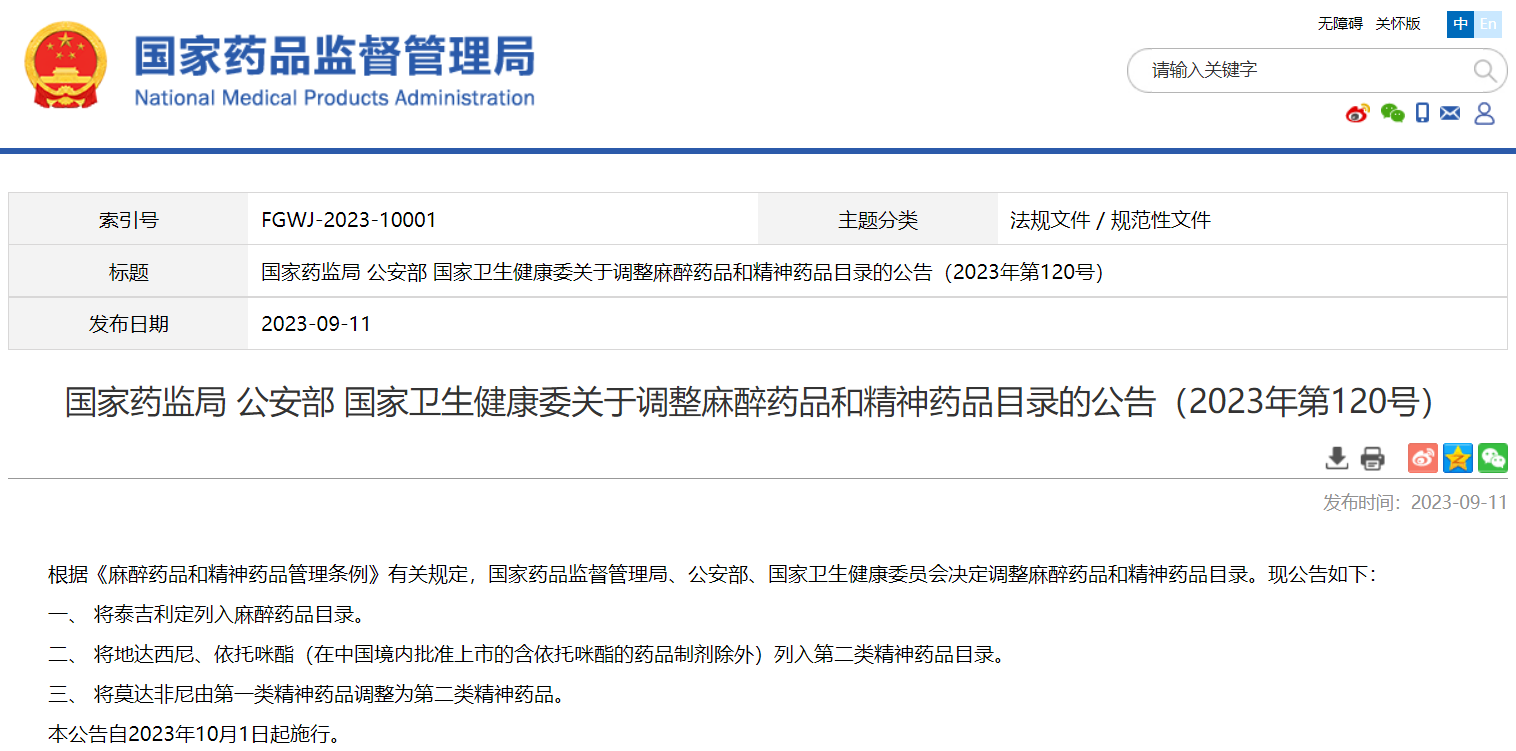
掃描識別圖中二維碼
查看詳細信息

02
國家藥監局關于小柴胡顆粒等3種藥品轉換為非處方藥的公告(2023年第119號)
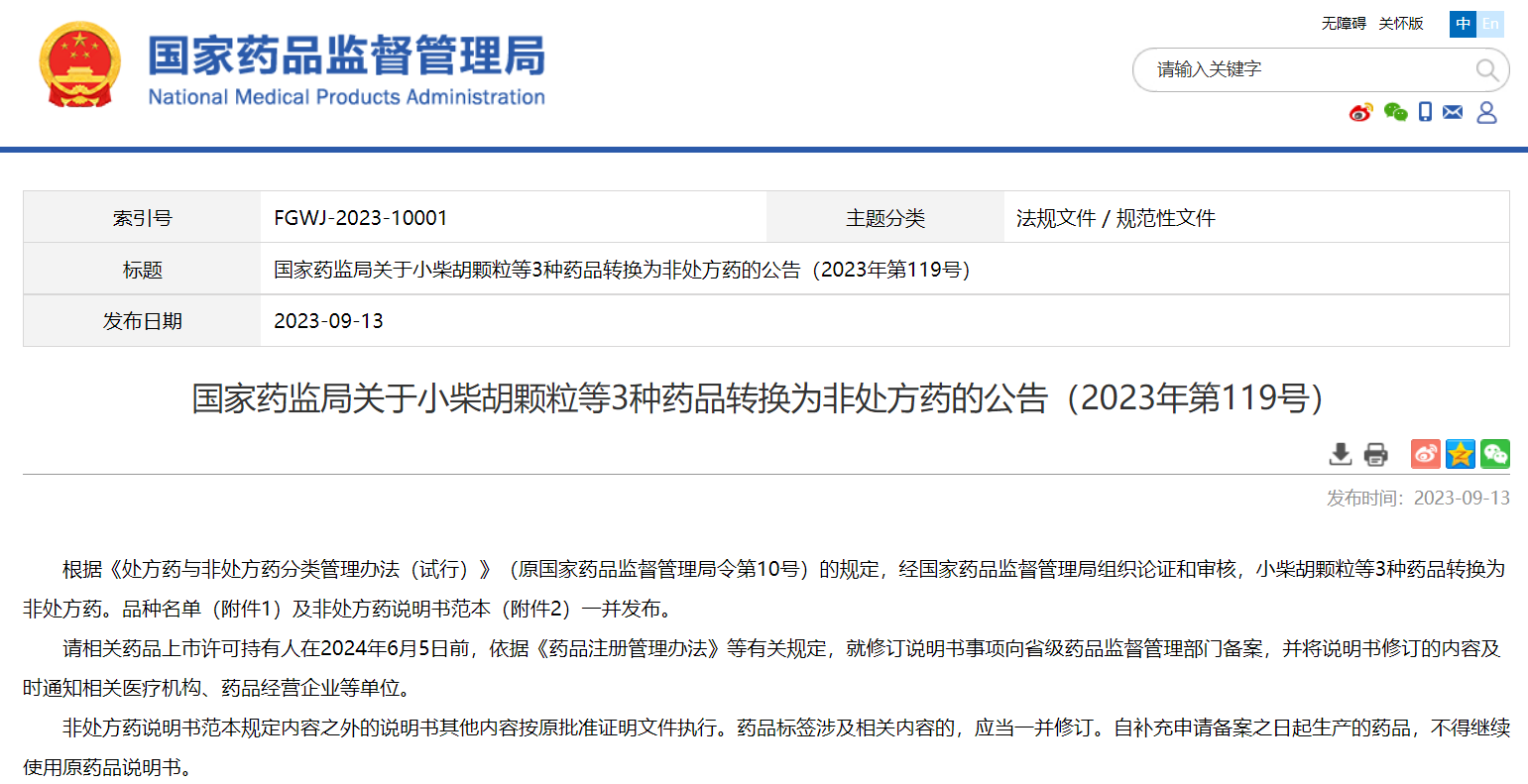
掃描識別圖中二維碼
查看詳細信息

CFDI
《Q9(R1):質量風險管理》國際人用藥品注冊技術協調會指導原則
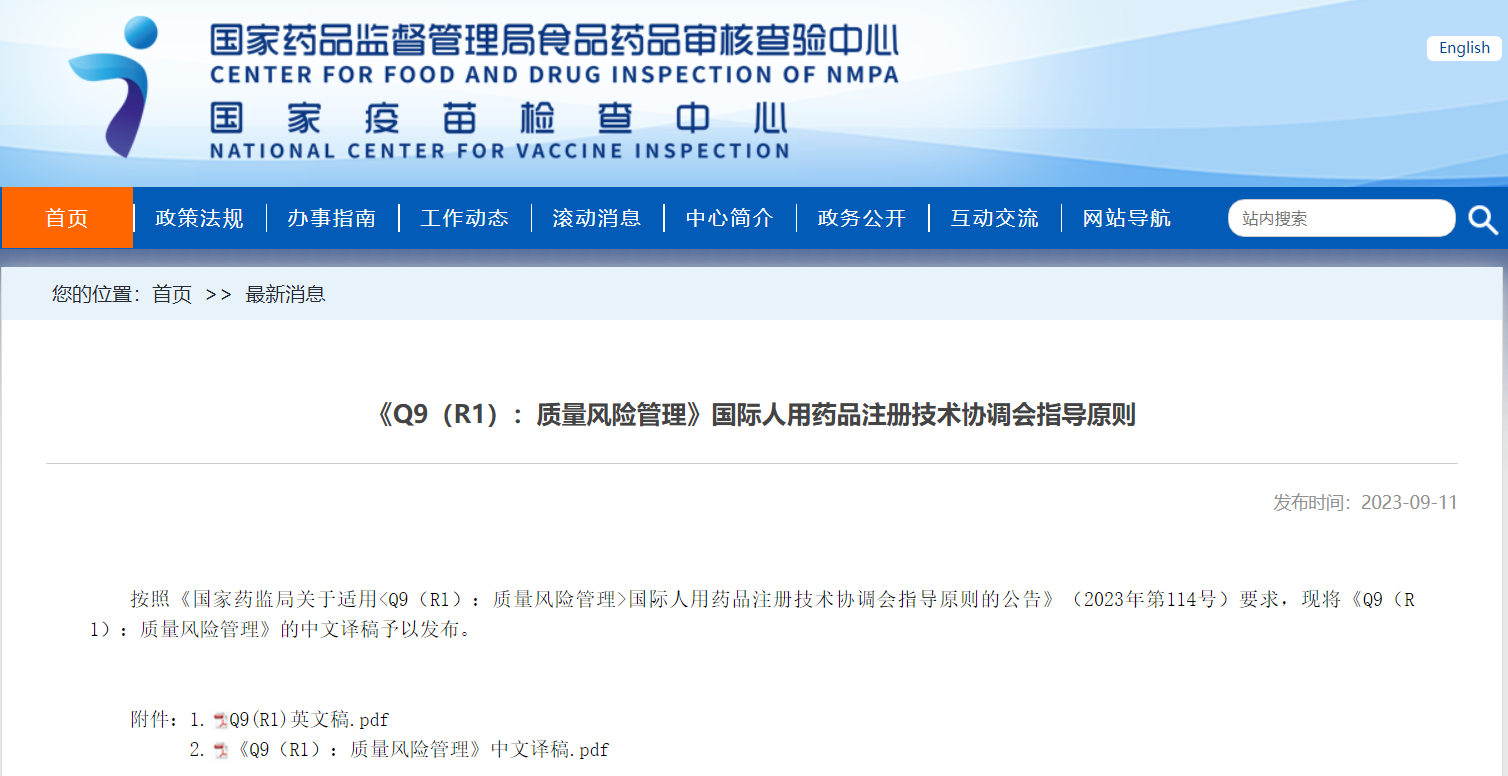
掃描識別圖中二維碼
查看詳細信息

藥典委
本周藥典委發布氨肽素、苯甲酸芐酯藥用輔料、藥品包裝用塑料容器及組件相關11個通則、不確定度評定指導原則、分析儀器確證指導原則標準草案,發布15種檢測分析方法標準草案。
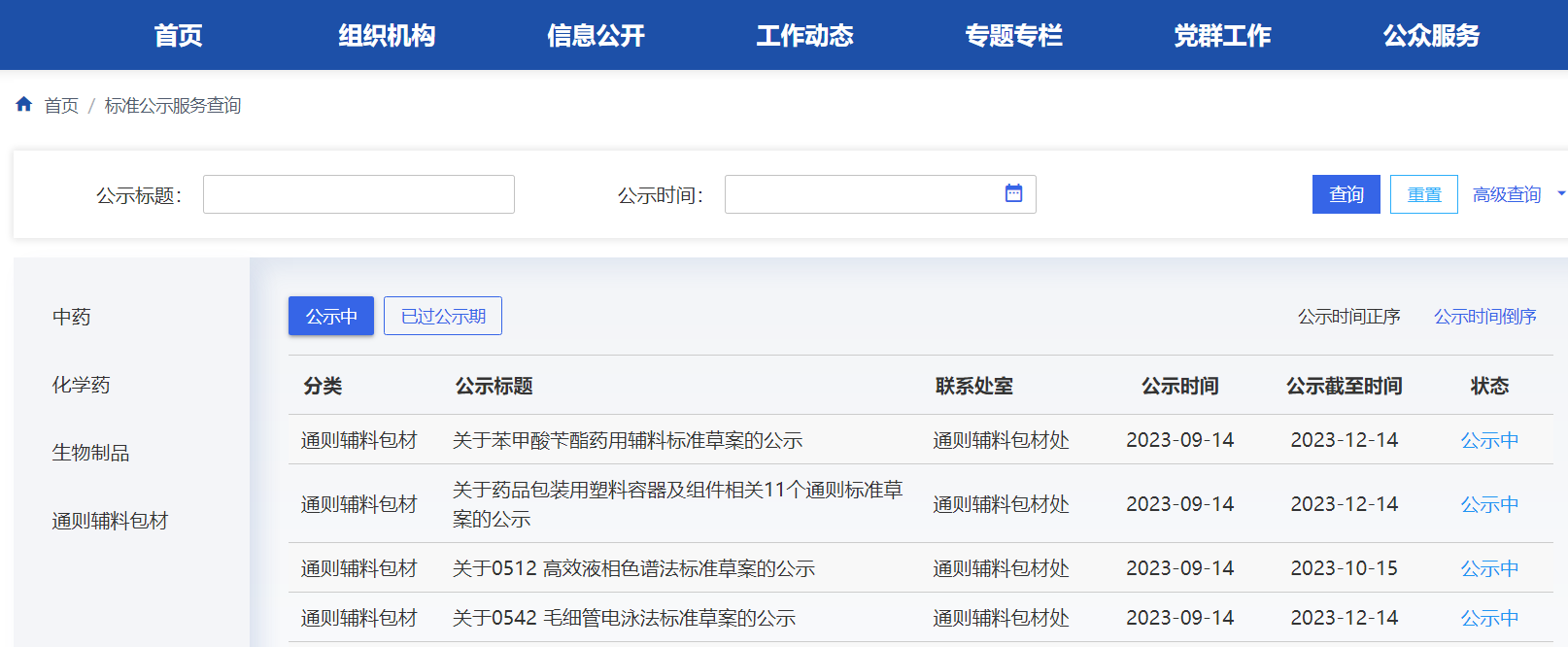
掃描識別圖中二維碼
查看詳細信息

-END-


轉載聲明:未經本網或本網權利人授權,不得轉載、摘編或利用其他方式使用上述作品。已經本網或本網權利人授權使用作品的,應在授權范圍內使用,并注明“來源:新領先醫藥科技”。

 Hotline服務熱線:010-83057670
Hotline服務熱線:010-83057670
 簡體中文
簡體中文

 010-83057670
010-83057670 聯系地址:
聯系地址: 技術市場部:
技術市場部: 北京新領先
北京新領先 新領先藥訊
新領先藥訊 010-61006450
010-61006450
